錆びた金属を放置しておくと腐食が進んで穴が開くことがります。
錆びて金属が侵された結果で穴が開くことになります。
これは金属と酸素が結びつくことによる酸化反応が原因です。
電子の移動が発生しているので電池と同じ反応と考えることもできます。
酸化とは
物質と酸素が反応することを酸化反応といいます。
鉄の表面に雨などで水分が付着します。
すると鉄の表面から電子が水の方へ移動します。
電子を失った鉄はイオン化することになります。
電子が移動した水のほうでは水と酸素と電子が反応して水酸化物イオンになります。
この発生した二つのイオンが反応して酸化鉄すなわち錆が発生することになります。
水と酸素で腐食が起きる
普段身の回りに存在する酸素と水が腐食の原因です。
水分は雨や結露によって金属表面に付着します。
金属製の部品の保管庫では湿度管理が重要です。
空気と接触しない水の中で腐食が進行するのは水の中に溶けている酸素が働くためです。
湿食と乾食
鉄を火で加熱して真っ赤になると表面が酸化して酸化鉄になります。
酸化の進行とともに鉄は失われていきます。
温度が高いほど進行度は高くなり、水を必要としない腐食を乾食といいます。
自然環境や酸による反応は水が関係しているので湿食といいます。
乾食は酸素に限らず様々なガスを扱う場面で起こります。
電池による腐食の見方
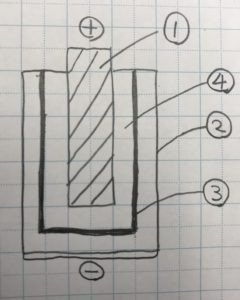
①炭素棒
②亜鉛(缶体)
③セパレーター
④電解質
マンガン電池に豆電球などの負荷を接続すると
①亜鉛缶から亜鉛イオンが溶け出す。
②亜鉛缶に残った自由電子が回路を通ってプラス極へ到達する。
③プラス極から炭素棒を通過して自由電子が電解液へ移動
④二酸化マンガンが電子を受け取る
電子がマイナス極からプラス極に移動するので電流が流れます。
金属がイオン化して失われていくのが腐食です。
異なった金属同士の接触による腐食
異種金属の接触により腐食は金属の組み合わせで発生します。
鉄がマイナス極、ステンレス、銅、チタンなどがプラス極になると電池が形成されます。
マイナス極の鉄が腐食していきます。
鉄がプラス極になる相手の材料はマグネシウム、亜鉛、アルミなどがあります。
異種材料接触腐食は水や土中といった電流が流れる環境に置かれている必要です。
プラス極からマイナス極の電路が成立して電流が流れます。
ステンレス鋼の不動態被膜
ステンレスは不動態被膜という腐食を妨げる被膜が表面にすぐにできます。
厚さは1ナノメートル程ととても薄く表面は金属の光沢がそのまま目に見えます。
この皮膜は特殊な酸化物です。
ステンレスのほかにアルミ、チタンなどが不動態被膜を作ります。
銅も腐食を妨げる被膜を作りますが1マイクローメートルでステンレスの被膜に比べると
かなり厚く、形成されるまでに大気中で数カ月ぐらいかかります。
ちなみに不動態被膜が破壊されるとステンレスも腐食をうけます。
pHが低い水溶液や、酸によって不動態被膜が溶かされるとステンレスの表面も
侵されていきます。
また塩化物イオン(海水など)にさらされる環境では局所的に不動態被膜が破壊され、
孔状に侵されていきます。



コメント