周期表
人類が発見した元素は118種類に及びます。
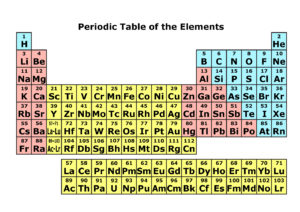
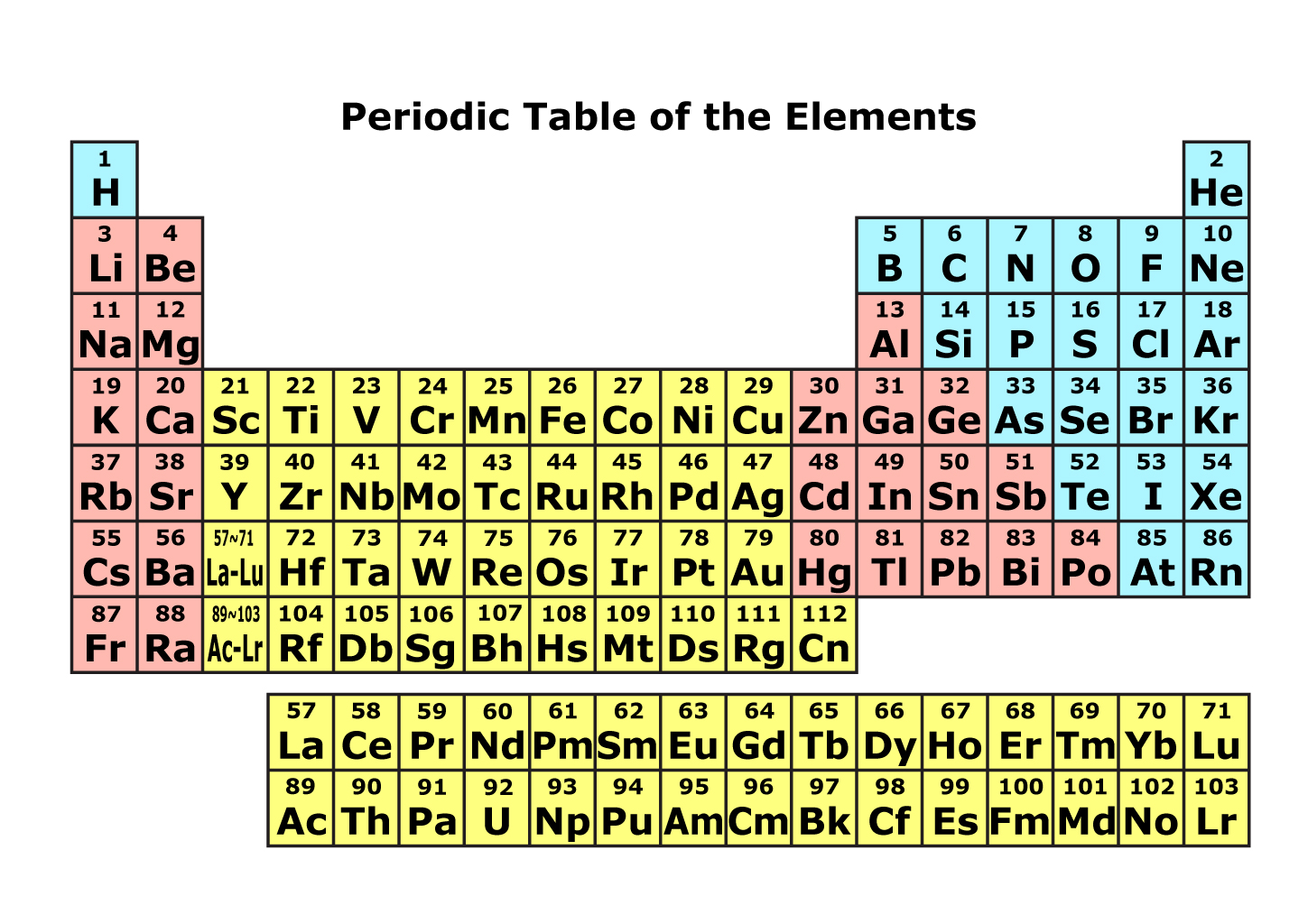
その元素を原子番号順に並べて縦の列を族、横の列を周期として性質が簡単に
判別できるようにまとめた表です。
原子はマイナスの電子とプラスの原子核(陽子+中性子)で構成されます。
この陽子は原子ごとに数が異なります。
原子番号
原子核に含まれる陽子の数を表します。
陽子は電気的にプラスの性質を持ちます。
その陽子につりあうように電気的にマイナスの性質を持つ電子が同数存在します。
また原子番号が大きい元素ほど重い元素になります。
周期
横の列を周期といいます。
周期はその元素がどの原子殻まで電子をもっているかを表します。
電子殻は内側からK殻、L、M、N、O、Pと分かれています。
外の殻に行けば行くほど多くの電子を保持することができます。
第一周期はK殻のみ、第二周期はL殻、第三周期はM殻、といった風になっています。
殻上に存在できる電子の数
- K殻 2個
- L殻 8個
- M殻 18個
- N殻 32個
- O殻 50個
- P殻 72個
- Q殻 98個
族
縦の列を族といいます。
左端が1族で右に行くにつれて2族、3族と増え右端は18族になります。
同じ族に並ぶ元素は性質が似ています。
また同族元素は最外殻に存在する電子の数が同じになっています。
1族では1個だけ、18族では8個(ヘリウムを除く)です。
この電子の数が性質を決めることになります。
最外殻に一つの電子しかない1族の元素は不安定で他の物質に渡され易い
性質があります。
すなわちほかの物質と反応しやすいということになります。
逆に18族の元素は最外殻に電子が満たされているので、ほかの物質と電子のやり取りが
無いのできわめて反応しにくい特徴があります。
アルカリ金属
水素を除く1族の元素は金属元素です。
これらをアルカリ金属といわれます。
1族の特徴としてほかの物質と反応しやすいことがあげられますが、
反応のしやすさからリチウムイオン電池などに使用されます。
遷移元素
3族から11族までは遷移元素と呼ばれます。
最外殻の電子の数は1個あるいは2個です。
遷移元素は族が異なる横の隣同士でも似た性質を持ちます。
チタン族
4族はチタン族元素です。
4個の電子を放出しやすく酸素や窒素と結合力が強い特徴があります。
このため酸素と結びついた状態で存在し、金属として単体で取り出すことが困難です。
チタンは酸素と結合して二酸化チタンとして存在していますが、製錬するには多くの工程と電力を必要とするためレアメタルに分類されています。
チタンとアルミを混ぜたチタン合金は軽さ、強さを持ちさびにくい優れた性質があります。
チタン合金は密度当たりの引っ張り強さを表す比強度が高くなります。
これは軽さのわりに強度が高いことを表します。
クロム族
6族はクロム族元素です。
クロム族元素は同じ周期の他の元素と比べると融点が高い特徴を持ちます。
硬い金属に分類されます。
融点はタングステンは3422℃、モリブデン2623℃です。
鉄にクロムを添加するとステンレス鋼になります。
クロムが酸素と結びつき不動態と呼ばれる被膜を作り出します。
不動態で表面を保護することで錆の浸食を防いでいます。
鉄にクロムとモリブデンを添加するとクロムモリブデン鋼。
軽くて強い材料として自転車のフレーム、包丁、工具に利用されます。
タングステンと炭素を結合させた炭素タングステンは
超硬金属の材料になります。
クロム族は硬さを生み出す働きをします。
鉄族
第4周期の8~10族の連続して並んでいる鉄、コバルト、ニッケルは鉄族元素と
呼ばれています。
鉄は含まれる炭素の量で強さが変わります。
炭素が多い鋳鉄は硬くてもろく、炭素が少ない鋼鉄は粘り強く強靭になります。
コバルトやニッケルも鉄に添加することで様々に性質を変化させます。
白金族
第5・6周期の8~10族の6種類の元素を白金族元素といいます。
ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム、白金の六種です。
化学的に安定していて酸やアルカリに強く侵されにくくなっています。
白金族元素は化学反応を促進させる触媒としての役割を持ちます。
三元触媒
白金、ロジウム、パラジウムを混ぜた触媒をさします。
自動車の排気ガスの有害ガスを環境にやさしい二酸化炭素や水に
変化する反応を促進させています。
銅族
11族は銅族元素です。
金と銀はイオンになりにくいので錆びたり溶けたりしにくい金属です。
銅もイオンになりにくい性質はありますが徐々に酸化していきます。
銅族元素は非常に加工のしやすい金属で柔軟に変形する「延展性」が優れています。
電気と熱を通しやすいことも特徴です。
加工しやすく電気を通しやすい性質があり価格の安い銅は導線や電気回路に
広く使用されています。




コメント